A espectroscopia mede a interação de substâncias com a radiação eletromagnética. Por meio de interpretações teóricas dos níveis de energia, geralmente baseadas na mecânica quântica, podem-se deduzir informações detalhadas a respeito das estruturas das moléculas ou dos cristais que originam os espectros. Muito simples, não é? Vamos simplificar ainda mais: Cada elemento reage de uma forma quando é submetido a uma radiação ou feixe luminoso. Bom, quando um feixe de radiação (luz branca, por exemplo) incide num meio absorvente, que pode ser uma solução colorida, parte da energia é absorvida pelas moléculas e o feixe emergente possui apenas a energia restante. Diz-se então, que houve “absorção” de radiação. A extensão com que a energia é absorvida pelo meio varia com o comprimento de onda da radiação incidente. Se esta é branca, o feixe emergente será colorido; sendo que a cor aparente da solução é complementar daquela que foi absorvida. Assim, uma solução que absorva na região do azul parecerá amarela, outra que absorva na região do verde parecerá púrpura etc. O conhecimento do comprimento de onda onde há maior absorção é muito importante para a determinação de concentrações.
Mas, como isso tudo ajuda nas análises? Bem, podemos fazer determinações quantitativas de soluções coloridas, através do percentual de absorbância do feixe. Para isso, determinamos qual o comprimento de onda máximo em que uma solução absorva ais intensamente, faz-se uma série de medidas com soluções-padrões, ou seja, de concentração conhecida; acha-se os valores da absorbância de cada uma das amostras e construímos um gráfico do tipo Absorbância x Concentração; onde os valores da concentração estarão no eixo das abcissas, enquanto que os valores da absorbância estarão no eixo das ordenadas. Depois, é só fazer a leitura da absorbância da solução-problema e comparar o resultado com os pontos marcados no gráfico e determinar a sua concentração.
A leitura da absorbância pode ser feita com um fotocolorímetro ou com um espectrofotômetro. A diferença entre eles é que o fotocolorímetro isola apenas uma determinada banda do espectro, enquanto que o espectrofotômetro permite variar o comprimento de onda até achar o comprimento de onda onde há maior absorção; esse aparelho é, portanto, mais preciso que o fotocolorímetro.
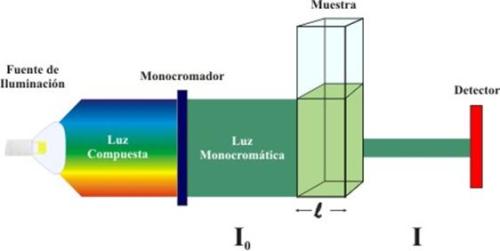
Para se fazer determinações quantitativas com base na absorção da radiação, usa-se a lei de Beer-Lambert, que pode ser escrita da seguinte forma:
| T% = | Pt |
| Po |
Onde:
T%= Percentual de transmitância do feixe incidido
Pt= Potência radiante transmitida
Po= Potência radiante incidida
Ou, se desejar obter o valor da absorbância:
A = –log T = a . b . c
Onde:
A = Absorbância
a = Índice de absorbância
b = Comprimento da cubeta
c = Concentração da solução

Oi sou estudante do curso de farmacia estou no segundo ano, cursando o terceiro periodo, gostaria de saber alguma coisa sobre cromatografia.
Preciso dessa informações pois terei de fazer um trabalho que fala sobre este assunto e gostaria de completar meu trabalho com mais informaçoes, e achei este site muito interessante.
Se vc puder me ajudar lhe serei muito grata…
obrigada.
CurtirCurtir
Greice, vc poderá ter mais informações sobre cromatografia AQUI.
Abraços.
CurtirCurtir
Muito bom André. Objetivo mas abrangente. Correto mas com uns toques de bom humor.
CurtirCurtir
A sua sogra AINDA não usa a internet… porque do jeito que as coisas evoluem….. heihiehieheihei Brincadeiras a parte.. o texto está muito bom.. gostei!
CurtirCurtir