 Aprendemos desde o início que matéria é tudo o que possui massa e ocupa lugar no espaço. Uma boa definição, mas meio sombria. Por que a matéria ocupa lugar no espaço? De que ela é feita? Se pegarmos uma pedra, poderemos quebrá-la indefinidamente? Já na Grécia antiga, os filósofos (como Demócrito e Leucipo) achavam que toda matéria era composta por minúsculas partículas indivisíveis denominadas “átomos” (A = não ; Tomos = divisível). O raciocínio era simples: uma substância sofreria sucessivas divisões, até que não hovesse mais nenhum modo de se partí-la. A esta pequeníssima parte da dita substância é que os gregos deram o nome de átomo. Tão simples assim?
Aprendemos desde o início que matéria é tudo o que possui massa e ocupa lugar no espaço. Uma boa definição, mas meio sombria. Por que a matéria ocupa lugar no espaço? De que ela é feita? Se pegarmos uma pedra, poderemos quebrá-la indefinidamente? Já na Grécia antiga, os filósofos (como Demócrito e Leucipo) achavam que toda matéria era composta por minúsculas partículas indivisíveis denominadas “átomos” (A = não ; Tomos = divisível). O raciocínio era simples: uma substância sofreria sucessivas divisões, até que não hovesse mais nenhum modo de se partí-la. A esta pequeníssima parte da dita substância é que os gregos deram o nome de átomo. Tão simples assim?
De qualquer forma, alguns séculos mais tarde (no séc. XIX para ser preciso), o cientista inglês John Dalton retornou a este assunto, propondo que o átomo realmente era uma pequeníssima esfera, maciça, indivisível, homogênea e de massa e volume que variavam de acordo com o elemento em questão.
Puxa, que ótimo, não é mesmo? Infelizmente isso não esclareceu muita coisa. O que Dalton quis dizer é que os elementos são diferentes entre si, porque suas minúsculas partículas formadoras são diferentes. Assim, seu volume, massa e demais propriedades físicas estavam intimamente ligadas à natureza destas partículas.

Em 1911, o cientista neozelandês Ernest Rutherford realizou o seguinte experiência: Ele encerrou certa quantidade de uma substância radioativa – o polônio (Po) – num bloco de chumbo (Pb) com um orifício ao centro. O Polônio emite certas partículas de carga elétrica positiva (denominadas “partículas ?”). Estas partículas passavam por uma placa de chumbo com um orifício também, atravessavam uma finíssima placa de ouro (Au) e atingiam um papel fotográfico comum, sensibilizando o mesmo. O esquema acima ilustra a experiência de Rutherford.
Rutherford notou que parte das partículas atravessavam a lâmina, enquanto que as demais desvia-vam ou mesmo retrocediam. Com isso, ele concluiu que a lâmina de ouro não era composta por átomos maciços e justapostos, como pensara Dalton. Muito pelo contrário, a lâmina deveria ser formada por núcleos pequenos, densos e positivamente carregados, dispersos em grandes espaços vazios. No esquema a seguir, você pode notar os círculos positivos (núcleos atômicos) e os feixes de partículas a que passam ou se desviam deles.

Como ele conseguiu este raciocínio? Muito simples: Sendo as partículas a possuintes de carga elétrica positiva, elas são repelidas por outra partícula de carga elétrica positiva (os opostos se atraem e os semelhantes se repelem), estas partículas têm que ser densas, pois, caso contrário, elas é que seriam deslocadas pelas partículas a e, finalmente, estas partículas estão em imensos espaços vazios, devido ao fato de só uma pequena parte das emissões se desviarem ou retrocederem.
Ora, ora. Agora surge uma dúvida: Se o ouro (Au), apresenta núcleos positivos, então como é que a lâmina é eletricamente neutra? Bom, como você deve estar fazendo agora, Rutherford imaginou que ao redor do núcleo positivo estariam girando partículas muito menores possuidoras de carga elétrica negativa, as quais foram denominadas “elétrons”. Bem, resumindo podemos dizer que o átomo seria como o nosso sistema solar, onde o núcleo positivo (cujas partículas foram chamadas de prótons) seria o sol e os elétrons, os planetas. Só que agora aparece mais uma dúvida: Se o núcleo é composto por várias partículas de carga elétrica positiva, então como é que estas partículas não sofrem repulsão entre si? De fato, se o núcleo fosse constituído apenas de partículas positivas, elas se repeleriam mutuamente, o núcleo deixaria de ser núcleo e o átomo não existiria. No núcleo existe também algumas partículas de carga elétrica nula denominadas “nêutrons”, os quais agem como se fossem verdadeiros “isolantes”, evitando assim a repulsão entre os prótons.
Posteriormente, o cientista Niels Bohr, através de cálculos matemáticos, chegou a algumas conclusões muito importantes:
- Enquanto o elétron estiver na mesma órbita, ele não emite nem absorve energia
- Ao receber uma quantidade bem definida de energia (denominada “quantum” ou, no plural, “quanta” de energia) o elétron salta para uma órbita mais externa
- Quando o elétron volta para a sua órbita de origem, ele devolve a energia recebida sob a forma de luz de cor bem definida, também chamada “fóton”.
Podemos visualizar as conclusões de Bohr através do seguinte esquema:
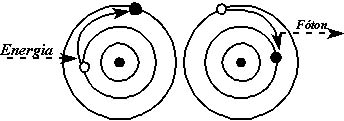
Obs. As cores que são emitidas variam de elemento para elemento, de modo que pode-se usar esta técnica, juntamente com outros ensaios, para determinar a persença de uma determinada substância. Esta é a base do ensaio de chama, em que se leva uma pequena amostra ao calor de uma chama e observa-se a cor que a chama adquire. Por exemplo, se a coloração for amarela, estará evidenciada a presença de sódio, se for verde será boro. Mas, este ensaio não é definitivo, pois algumas substâncias emitem cores similares.
Mais tarde descobriu-se a existência de sete camadas eletrônicas, onde as órbitas eletrônicas de todos os átomos se agrupam; as quais receberam os nomes: Camadas K , L , M , N , O , P e Q. Como em cada camada os elétrons possuem uma quantiodade fixa de energia, as camadas são também chamadas “níveis de energia”. Além disso, cada camada comporta um número máximo de elétrons. Desse modo, temos:
| Camada | N° de elétrons |
| K | 2 |
| L | 8 |
| M | 18 |
| N | 32 |
| O | 32 |
| P | 18 |
| Q | 2 |
Níveis e sub-níveis eletrônicos
O modelo atômico de Rutherford-Bohr (consistindo em órbitas eletrônicas circulares) foi aos poucos substituído pelo modelo de orbitais. Um cientista de nome Heisenberg estipulou o seu “Princípio da incerteza”, que nos diz que não se é possível determinar o local onde um determinado elétron estaria em determinado momento, nem a que velocidade ele estaria desenvolvendo neste momento. Devido a esta incerteza, o cientista Erwin Schrödinger iniciou cálculos onde se poderia determinar uma certa região onde houvesse maior probabilidade de se encontrar um elétron. A esta região é delimitada por uma equação matemática, e esta equação é que denominamos “Orbital”.
Agora, passaremos ao estudo dos números quânticos. Cada um dos elétrons possui uma certa quantidade de energia; e esta energia é crescente, de acordo com o nível em que eles se encontram. Complicou? Descompliquemos: Um elétron possui uma quantidade de energia superior ao elétron que está em uma camada logo abaixo, mas inferior a o elétron da camada mais acima (lembra-se que foi dito a respeito da lei de Niels Bohr?). Cada uma das sete camadas é, portanto, um nível energético; este nível é o “Número Quântico Principal”. Ele é designado pela letra n e varia de 1 a 7.
Em cada camada existe o que poderíamos tranqüilamente chamar de “degraus energéticos” (é claro que esse termo eu estou inventando agora para facilitar). Esses “degraus” são subníveis energéticos; de cada degrau para o seguinte, há um aumento no conteúdo de energia do elétron. Tais subníveis são conhecidos pelo número quântico secundário ?, assumindo valores de 0 a 3; e são habitualmente designados pelas letras s, p, d e f. Como exemplo, podemos citar a posição 3p, que nos informa que se trata do segundo degrau da terceira camada.
Os orbitais são identificados pelo número quântico magnético M?, assumindo valores de –? a +?. Finalmente, cálculos matemáticos provaram que um orbital pode comportar no máximo dois elétrons; estes elétrons podem girar no mesmo sentido ou não (sentido paralelo ou anti-paralelo), criando assim campos magnéticos que os repelem ou os atraem; tal rotação é conhecida como “spin”. O spin é identificado pelo número quântico de spin Ms, cujos valores são: +1/2, representado por um seta vertical para baixo, e –1/2, representado por uma seta vertical para cima.
Estes são os quatro números quânticos. Não há dois elétrons com os quatro números quânticos iguais. Eles funcionam como uma verdadeira “carteira e identidade” de nossos amigos possuinte de carga elétrica negativa.
Configuração eletrônica
Assim como nas camadas (ou níveis), em cada subnível há uma quantidade máxima de elétrons. A soma dos elétrons de todos os subníveis fornecerá a quantidade de elétrons da camada (ou nível) que está sendo examinada, conforme a tabela 1, e a soma destes quatro números deverá ser 32 (o maior número de elétrons existentes num mesmo nível), conforme nos mostra a tabela 2.
TABELA 1
|
TABELA 2
|
Para ajudar na determinação da configuração eletrônica de um determinado átomo, fazemos uso do “Diagrama de Pauling”, criado pelo químico americano Linus Pauling, mostrado abaixo:

Se alinharmos utilizando as setas como guias, obteremos o seguinte:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Desse modo, podemos encontrar a configuração da maior parte dos elementos da tabela periódica. Mas, com um exemplo fica melhor para entender, certo?
Ex. Determinar a configuração eletrônica do escândio (21Sc45) em níveis e subníveis.
| Sub-níveis | Níveis | |
| K | 1s2 | 2 |
| L | 2s2 2p6 | 8 |
| M | 3s2 3p6 3d1 | 9 |
| N | 4s2 | 2 |
CONFIGURAÇÃO EM NÍVEIS: K = 2 ; L = 8 ; M = 9 ; N = 2
CONFIGURAÇÃO EM SUB-NÍVEIS: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
OBSERVAÇÕES:
- Não se deve esquecer que as transferências de elétrons acontecem nos níveis mais externos, com isso, ao fazer as configurações em que haja ganho ou perda de elétrons, deve-se fazer primeiro a configuração do átomo em estado normal, para depois acrescentar ou subtrair o(s) elétron(s) em questão; evitando, assim, erros.
- A distribuição dos elétrons em níveis e subníveis não pode ser aplicada a todos os átomos indiscriminadamente. Os principais átomos que fogem a esta regra são: Cobre (Cu) , Cromo (Cr) , Paládio (Pd) , Platina (Pt) , Prata (Ag) , Ouro (Au) etc.

Muito bem elaborado, estão de parabéns!
CurtirCurtir
Este escritor está de parabéns,por que é um texto claro e explicativo.Ajuda um desenformado a se ver livre das notas baixas.
CurtirCurtir
rapaz eu preciso saber como usar o diagrama de pauling na tabela periodica tipo na familia “b”
to cofusa e tenhu prova amanhã se puderem me ajudar
CurtirCurtir
Catharina
O diagrama de Pauling não serve para os elementos de transição (a família B).
Sobre os metais de transição, vc pode ler aqui: http://inorgan221.iq.unesp.br/quimgeral/metaltr/Metais_Trans.htm
Abraços.
CurtirCurtir
irado, interessante.
CurtirCurtir
como um elétron não sai do orbital já que eles se repulsão?????
CurtirCurtir
O movimento dele faz com que ele permaneça na órbita. a atração do núcleo faz com que ele não saia pela tangente. Assim acontece com o Sistema Solar. Se o Sol, os planetas sairiam “voando” por aí.
Os elétrons não se repulsam mutuamente dado o pequeno tamanho deles.
CurtirCurtir